作者/宏恩綜合醫院 胃腸肝膽科 譚健民 文章出處/摘錄自《台北市醫師公會會刊,2017年 第61卷 第9期》
前言
基本上,激躁性腸道症候群(irritable bowel syndrome, IBS) 俗稱為腸躁症,是一種常見的功能性胃腸道疾病,在臨床上其主要表現為腹痛與排便習慣的改變。IBS是一種非器質性的胃腸功能紊亂性疾病,基本上是以腹痛與排便習慣改變為其主要症狀的一組臨床症候群。根據最新的羅馬IV標準將其分為腹瀉型、便祕型、混合型以及不定型IBS等四大類型。IBS的診斷需在有反覆腹痛(腹痛發作至少每個星期出現1天)的基礎� ��,再加上以下兩項以上的臨床症狀即可成立明確的診斷,其中包括有:1. 腹痛與排便有其相關性,即排便後腹部症狀得以緩解;2.伴隨排便頻率的改變;3. 伴隨糞便形狀的改變。每個典型IBS症狀持續的時間需至少3個月,其中首發症狀需持續至少6個月以上1。
IBS的流行病學2
IBS全世界盛行率為5-20%,在已開發的歐美國家中其盛行率為9-22%,亞洲地區國家為4-10%,約佔胃腸專科門診的20-50%。青年人口群、女性、高學歷、高收入人口群為IBS的好發人口群,其高峰集中在40-50年齡層中。西方人以便祕型為主,而東方人則主要以腹� �型為主。
由於IBS對患者本身的生活品質以及社會經濟會造成重大的影響,因此在臨床上一直都受到醫病的重視。截至目前為止,IBS真正的致病機制尚未十分完全明確,但已知是IBS是由多種不同因素共同協力導致的結果,其中最為大家認同的有內臟感覺過敏、腸道動力異常、腸道感染後、小腸細菌過度生長(small intestinal bacterial overgrowth, SIBO)症候群、精神心理因素、社會因素、遺傳因素、腦-腸軸(brain-gut axis)失調以及近些年來的腸道菌群改變理論的影響。因此,本文就IBS可能的致病機制的研究文獻做回顧性的探討。
IBS的致病機制3,4
由過去的多個研究結果中,顯示生活習性、多態性遺傳基因、食物過敏、心理因素、腦-腸軸異常以及腸道菌群失調可能是IBS的主要致病因素,而其中腸道菌群的失調在IBS發生的過程中更扮演著極為重要的角色5, 6, 7。
有研� ��指出,IBS與某些生活習性有關,其中包括有長期飲食不規律或節食、喜食甜食、咖啡、濃茶,長期大量飲酒及吸菸,都可因而導致胃腸道運動功能失調而衍生IBS的誘發因素4。
基本上,食物過敏可以導致細胞組織發生炎症反應,使個體產生分泌型免疫球蛋白A(Secretory Immunoglobulin A, SIgA),並進一步與食物顆粒形成免疫複合物,而促發腹痛及腹瀉等症狀。此外,根據食物的特異性IgG抗體可以避免接觸過敏食物而減輕IBS症狀的發生。
伴隨生物-心理-社會的新型醫學模式的確立,IBS的心理因素亦逐漸受到大家的重視。由多項研究顯示憂鬱、焦慮、壓力、緊張、睡眠障礙等皆是IBS的危險因子。由於情感中樞與支配消化道運動以及內分泌調節中樞共處於同一解剖部位,一旦個體情感心理發生變化時,則會對胃腸道產生一定影響,而導致腹瀉、便祕以及腹痛等IBS的臨床症狀。
腦-腸軸是維持中樞� ��經系統、腸道神經系統(enteric nervous system) 、自主神經系統、下丘腦-體-腎上腺軸(hypothalami-pituitary-adrenal axis) 、腦腸肽如P物質、降鈣素基因相關肽(calcitonin generelated peptide)、神經肽、血管活性腸肽(vasoactive intestinal polypeptide)、生長抑素等眾多交互作用通路的穩定性。CNS 收集來自於胃腸道的訊息,將其整合後經腸道神經系統及神經-內分泌系統傳遞給胃腸道的神經叢或平滑肌細胞,更經由腦-腸軸上的其他通路如內臟刺激神經傳導通路、神經-內分泌-免疫調節通路以及應激作用通路,來維持個體一旦其中一個通路出現障 礙時,則可分泌相關神經化學傳導物質作用於胃腸道而引起IBS症狀的衍生3, 5,因此IBS患者必然存在腦-腸軸功能的失調。
之前理論上認為IBS病因中的飲食、心理創傷、焦慮以及遺傳扮演著重要的角色,但近些年來已有多項研究顯示基因多態性與IBS相關,其主要包括有5-羥色胺轉運體多態性(serotonin transporter polymorphism) 、腎上腺素受體類基因多態性、細胞因子介白素-10(cytokine interleukin IL-10) 及腫瘤壞死因子-α(tumor necrosis factor-α, TNF-α)、腸道屏障基因多態性以及心理因素基因多態性都與IBS的衍生有關。一旦這些基因某個亞型位點發生突變或缺失,便會出現基因表達異常,從而引起IBS的相關症狀8-10。
此外,Moayed P等人11亦指出有2% IBS患者的SCN5A發生基因突變,其中 大多數是功能喪失的突變,因而破壞NaV1.5通道功能,這是胃腸道平滑肌與心臟節律點間的主要鈉離子通道,因此會進一步影響腸道功能,而衍生IBS。這些發現為IBS及其可能治療的選擇提供了新的致病機制。
感染後IBS(post-infectious irritable bowel syndrome, PI-IBS)是指急性腸道感染恢復後出現符合IBS的臨床症狀,而之前個體並無IBS相關的臨床表現。大部分人群的胃腸道感染可在數天內恢復,但約有10%的病患其胃腸道症狀仍持續存在,從而發展為IBS� ��在IBS罹患者中約有3.7-36%的既往歷中曾有胃腸道病毒、細菌及寄生蟲的感染史。因此,PI-IBS患者的糞便菌群與黏膜菌群的多樣性均低於健康對照者,而PI-IBS患者的腸道菌群與IBS-D患者相類似,由此顯示兩者可能具有共同的病理生理學的致病機制。
由研究中亦指出,曾患急性胃腸炎患者發生IBS的概率較未罹患急性胃腸炎的患者高出6-7倍。由於感染後腸道黏膜屏障破壞,黏膜肥大細胞增多並通過釋放組胺、5-羥色胺等物質使腸道收縮異常,� �道通透性及敏感性也因而增加,並從而導致IBS。此外,腸道感染亦可通過作用於菌群-腦-腸軸,而促使抗炎、抑炎細胞因子表達異常而引起IBS。
再者,個體過度不當使用抗生素不僅會破壞腸道黏膜屏障,且可使腸道菌群數量以及屬種發生改變,不僅導致耐藥菌株異常大量繁殖,更會進一步造成多重感染,因為抗生素通過作用於細菌生物合成所需物質如核糖體、DNA與RNA聚合酶、細胞膜、細胞壁來干擾細菌的生長。
腸道菌群失調(gut dysbiosis)12-15, 17
基本上,腸道是宿主與細菌之間重要的互動聚點。細菌在出生後立即定植在胃腸道中,人體腸道內微生物中細菌佔了99% 以上,總數多達100萬億,種類超過1,000種,總重量約1公斤,大約是人體自身細胞數量的10倍,其編碼基因是人體基因數目的100倍。
腸� ��菌群主要分為四大門類,即厚壁菌門(Firmicutes)、擬桿菌門(Bacteroidetes)、放線菌門(Actinobacteria) 以及形菌門(Proteobacteria)。不同胃腸道部位菌群的構成與濃度亦不相同,胃及小腸細菌較少,其主要為需氧菌如乳酸菌屬、鏈球菌屬;結腸細菌濃度高達1011-1012 /公克結腸內容物,其主要為厭氧菌如擬桿菌屬、梭菌屬、雙歧桿菌屬、腸桿菌屬;而大腸盲腸則以兼性厭氧菌為主,其佔總菌數量的四分之一,其優勢菌群為厭氧菌,以雙歧桿菌、類桿菌為主。體內菌群按一定比例及數量處於動態平衡狀態之中,相互依存,相互約束,並與宿主共生共存。一旦動態平衡被打破,腸道菌群因而失調,則可破壞黏膜屏障,使腸道功能紊亂,增加內臟敏感性� ��啟動腸道免疫反應,從而引起IBS臨床症狀18。
由近40年來的研究顯示,腸道菌群與免疫系統緊密相連,某些細菌對於人類正常生理功能而言,是具有其存在的必需性,因其有助於維持人類體內生態平衡,這些細菌也已被證實有助於維持人類腸道上皮細胞(intestinal epithelial cells, IECs)固有結構與功能的完整性,以及關係到血管生成以及IECs的形成與發育。此外,細菌本身會在人類先天以及後天免疫系統作業中,扮演著保護人類腸道上皮,以免其發生炎症反應。基本上,上皮細胞在調節腸道免� ��中具有其核心的地位,因其可通過保持穩定溫度以及提供足夠營養,使細菌能擁有一個良好的作業及生存的微小環境。再者,益生菌本身更可促進消化、吸收以及熱量的儲存,這些或許是哺乳動物無法自行進行給與的。因此,腸道菌群不僅是一個龐大而又複雜的微生態系統,其生理意義尚有促進免疫器官的免疫反應、啟動免疫因子、增強免疫功能以及提高宿主的抗病能力2,12-14。因此,腸道菌群失調及腸道微生態環境發生變化,均可能會引起一系列的臨床症狀如腹瀉、腹脹、糞便形狀異常以及排便習慣改變。
近年來,有不少臨床研究發現「腸道菌群」的紊亂是
SIBO是由於某種原因引起小腸內細菌種類與數量異常所導致的一組臨床症候群,其主要表現為吸收不良、腹� �及腹瀉等與IBS 相似的症狀。由研究顯示,SIBO在IBS患者腸道菌群失調中發揮著重要的作用。在正常情況之下,小腸比其他胃腸道具有較強的蠕動能力,在胃液、胰液以及膽汁混合液的環境下,細菌是難以定植於小腸內的。一旦發生小腸動力障礙、結構異常(輕者如腸沾黏所衍生的部份腸阻塞)、胃酸缺乏(低胃酸甚至無酸症或由藥物導致)以及個體免疫功能下降時,結腸內細菌菌群即有可能易位至小腸內定植生長,因而發生SIBO。SIBO一旦存在其可影響小腸動力、增加內臟敏感性、產生過量氣體、啟動腸道黏膜免疫反應以及增加腸道滲透性,從而加重IBS腸道症� �的發生。在臨床上,某些IBS個案使用抗生素治療,而使得部分IBS患者的症狀得以緩解,由此亦可間接証明IBS與SIBO兩者相關性的存在8。
近些年來,由於分子醫學的進步,在臨床上已被大家確認的益生菌基本生理功能機制包括有:一、益生菌與病原菌共同競爭所需要的生長營養素。益生菌與致病菌爭奪營養,從而促使致病菌得不到營養,而不能在腸內繼續繁殖與生長。二、阻斷病原菌在腸黏膜上結合的部位,使得病原菌不再著床在腸黏膜上皮細胞上,來達到繁殖生長的目的。大多數益生� ��屬於厭氧菌,厭氧菌與黏膜上皮結合較為緊密,並形成一層特殊的生物膜,而可由此阻擋病原菌的侵入,使得外來菌沒有可吸附的空間及位置,並由此維持良好的微生物生態環境的動態平衡。三、使得益生菌/病原菌在腸道菌群中呈現最佳壓倒性數量黃金比例(6:1) 。因此,益生菌在防止小腸細菌過度生長及增強腸道屏障方面扮演著極為重要的角色。四、益生菌會局部刺激黏膜上表皮的免疫作用機制。益生菌可以通過直接改變腸道定植菌群的種類,或間接增強腸道屏障功能來修飾腸道菌群失調,並進一步激活宿主的免疫功能,從而抑制異常腸道炎症反應的發生。五、直接在對抗病原時會分泌出細菌素(bacteriocin)來對抗特定的病原菌。益生菌可在腸道產生氧化氫、有機酸、殺菌素以及抗生素等 ,其不利於需氧菌及外來致病菌在大腸管腔的生長與定植的過程。
因此,IBS罹患者中的腸道微生態變化的主要表現包括有:1. 腸道優勢菌群數量減少;2. 腸道微生物群多樣性及穩定性被破壞;3. 益生菌如乳酸桿菌與雙歧桿菌數量減少,而有害菌屬如大腸菌群與擬桿菌屬數量的增加;4. 腹瀉型IBS較便祕型 IBS患者的腸道微生態結構與數量的變化更為顯著。
此外,在IBS腸道菌群失調中,腸道微生物定植抗力可反映腸道菌群的改變。雙歧桿菌/大腸桿菌數量比值(B/E值)可作為腸道微生物定植抗力的指標,B/E值<1表示定植抗力減弱。不同臨床症狀的IBS患者,其菌群變化與B/E值亦不相同,腹瀉型IBS以大腸桿菌數量增加為主,雙歧桿菌及乳桿菌數量與B/E值均明顯降低;便祕型IBS以擬桿菌數量增加為主,其餘菌群變化不太顯著;混合型IBS大腸桿菌數量增加為主,使得乳桿菌數量與B/E值明顯降低14。
益生菌是一種定植在宿主體內,用以調節體內菌群生態平衡,從而促進宿主健康生活的良好腸道菌群。益生菌主要成員是各種雙歧桿菌及乳酸桿菌,約佔腸道菌群的百分之八十。益生菌是人體健康不可或缺的,其可以合成各種維生素,參與食物消化,促進� ��道蠕動,抑制病原菌的生長以及分解有毒害的代謝物質。因此,益生菌經由調節個體免疫、增強腸道屏障、競爭性黏附黏膜等作用機制來改善腸道功能。由研究中亦顯示,補充益生菌能夠改變腸道菌群的結構與數量,並可明顯緩解IBS症狀19, 20。
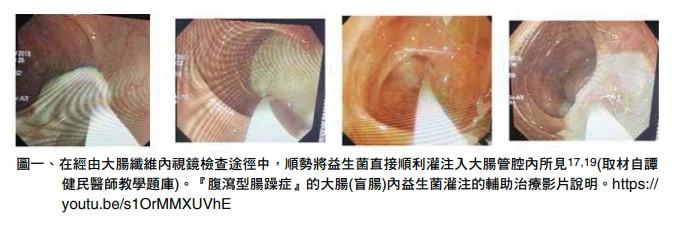
近些年來,「宏恩綜合醫院無痛麻醉胃腸內視鏡早期胃腸道癌症篩檢醫療團隊」由臨床實務經驗得知,在經由胃腸內視鏡檢查過程中(圖一),順勢給與益生菌的胃腸內灌注,其效益確實比口服益生菌途徑來得更為顯著,因胃腸內益生菌灌注可將益生菌數量在一個很� �時間內,即時達到其與病原菌的黃金比例(6:1),如此更能即時展現其對人體的利益18-20。
結語及未來展望
目前 IBS致病機制尚未很明確,上述諸多研究亦顯示 IBS患者普遍存在著腸道菌群紊亂的現象,而以益生菌為主的腸道菌群做為標靶來調整腸道菌群結構及重建腸道微生態的確能夠緩解IBS的症狀。隨著內視鏡技術以及分子生物學技術的發展,未來研究應著手於瞭解IBS患者腸道菌群的具體改變以及其致病機制所在。
雖� �,由近幾十年的研究中尚未發現與IBS致病有關的特異性腸道菌群甚至某種特異性細菌。但已明確發現IBS患者除了優勢菌定植能力降低、腸上皮屏障功能減弱外,細菌抗原、細菌DNA亦可能經特定途徑,導致免疫反應參與IBS的發生。目前,儘管對於IBS患者的腸道菌群的常規培養困難與菌群複雜性等問題的存在,但隨著實驗方法與新技術的發展應用,期盼在不久的將來可以腸道菌群作為標靶的IBS治療能明確的提供一個新興的治療方針。
參考文獻
1.König J, Brummer RJ: Alteration of the intestinal microbiota as a cause of and a potential therapeutic option in irritable bowel syndrome. Benef Microbes 2014; 5: 247-61.
2.Schoenfeld PS. Advances in IBS 2016: A Review of Current and Emerging Data. Gastroenterol Hepatol (N Y) 2016; 12 : 1-11.
3.Borghini R, Donato G, Alvaro D, Picarelli A. New insights in IBS-like disorders: Pandora's box has been opened; a review. Gastroenterol Hepatol Bed Bench 2017; 10: 79-89.
4.Lenhart A, Chey WD. A Systematic Review of the Effects of Polyols on Gastrointestinal Health and Irritable Bowel Syndrome. Adv Nutr 2017; 8: 587-596.
5.Kinsinger SW. Cognitive- behavioral therapy for patients with irritable bowel syndrome: current insights. Psychol Res Behav Manag 2017; 10: 231-37.
6.Carroll IM, Ringel-Kulka T, Siddle JP, et al: Alterations in composition and diversity of the intestinal microbiota in patients with diarrhea-predominant irritable bowel syndrome. Neurogastroenterol Motil 2012; 24: 521-30.
7.Chassard C, Dapoigny M, Scott KP, et al: Functional dysbiosis within the gut microbiota of patients with constipated-irritable bowel syndrome. Aliment Pharmacol Ther 2012; 35: 828-838.
8.Ghoshal UC, Shukla R, Ghoshal U: Small Intestinal Bacterial Overgrowth and Irritable Bowel Syndrome: A Bridge between Functional Organic Dichotomy. Gut Liver 2017; 11: 196-208.
9.Park JM, Choi MG, Park JA,et al: Sertonin transporter gene polymorphism and irritable bowel syndrome. Neurogasroenterol Montil 2006; 18: 995-1000.
10.Zhang XM, Lin ZH: Relationship between Serotonin Transporter Gene Polymorphism and Irritable Bowel Syndrome. Shijie Huaren Xiaohua Zazhi 2006; 14: 1790–94
11.Beyder A, Mazzone A, Strege PR, et al: Loss-of-function of the voltage-gated sodium channel NaV1.5 (channelopathies) in patients with irritable bowel syndrome. Gastroenterology 2014; 146: 1659-68.
12.Moayyedi P, Ford AC, Talley NJ, et al: The efficacy of probiotics in the treatment of irritable bowel syndrome: a systematic review. Gut 2010; 59: 325-32.
14.Salonen A, de Vos WM, Palva A: Gastrointestinal microbiota in irritable bowel syndrome: present state and perspectives. Microbiology 2010; 156: 3205-3215.
15.Tack J, Vanuytsel T, Corsetti M: Modern Management of Irritable Bowel Syndrome: More Than Motility. Dig Dis 2016; 34: 566-73.
16.Wilkins T, Sequoia J. Probiotics for Gastrointestinal Conditions: A Summary of the Evidence. Am Fam Physician 2017; 96: 170-78.
17.譚健民:� ��同益生菌給與途徑的分析與探討∼著重於一個醫師的順勢胃腸內灌注益生菌的前瞻式研究經驗的分享(初報)。台北市醫師公會會刊。2017;61:40-46.
18.Yuan F, Ni H, Asche CV, et al: Efficacy of Bifidobacterium infantis 35624 in patients with irritable bowel syndrome: a meta-analysis. Curr Med Res Opin 2017; 33: 1191-97.
19.譚健民:益生菌在消化系統疾病診治上所扮演角色的今日觀。台北市醫師公會會刊。2016;60:31-40.
20.譚健民:益生菌在臨床診治上所扮演角色的現代觀∼著重於一種大腸內益生菌灌注的新興療法之探討。2016年07月號永信藥訊電子報。

本文轉載自 KingNet國家網路醫藥
沒有留言:
張貼留言